Šiame skyriuje nagrinėsime vandens molekulės sandarą. Aiškinsimės, kokias medžiagas tirpina vanduo. Nagrinėsime, kuo elektrolitai skiriasi nuo neelektrolitų. Išmoksime įvairiais būdais išreikšti medžiagos koncentraciją. Susipažinsime su medžiagų kiekio matu – moliu. Išsiaiškinsime, kas yra kristalohidratai.
Pakartokime
Prisiminsime aštuntoje klasėje nagrinėtas sąvokas, kurių prireiks aiškinantis naują informaciją.
Medžiagos
Daiktai, skysčiai, oras – visa tai sudaryta iš medžiagų. Pavyzdžiui, arbata (1.1.1 pav.) yra įvairių medžiagų mišinys. Daugiausia joje vandens H2O. Tai neorganinė medžiaga. Stimuliuojamųjų savybių arbatai suteikia organinė (anglies, vandenilio ir kitų elementų turinti) medžiaga – kofeinas C8H10N4O2. Dar arbatoje yra spalvą, kvapą, skonį suteikiančių medžiagų.
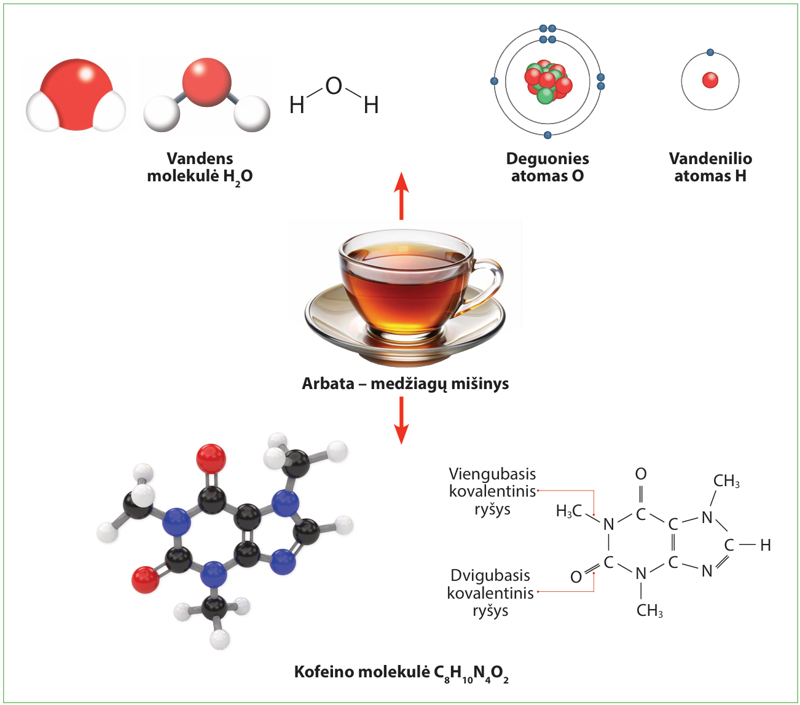
Periodinė lentelė
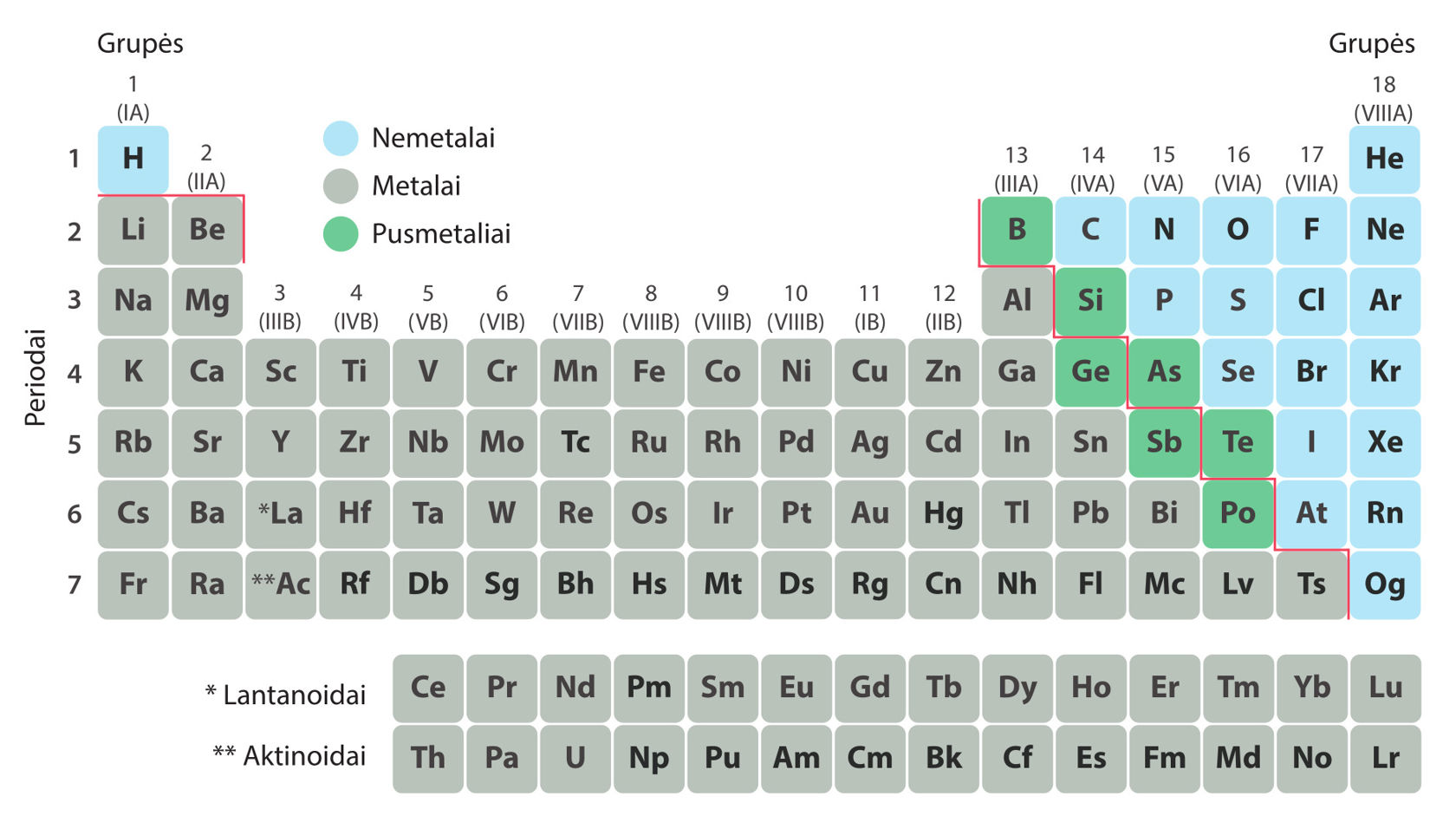
Cheminiai elementai periodinėje lentelėje (1.1.2 pav.) surikiuoti branduolyje esančių protonų skaičiaus didėjimo tvarka. Vandenilis turi vieną protoną, todėl įrašytas pirmas. Helis turi du protonus, litis – tris, ir t. t. Gulsčiosios lentelės eilutės vadinamos periodais. Visi vieno periodo elementai turi vienodą elektronų sluoksnių skaičių. Pavyzdžiui, antrojo periodo elementų (nuo ličio iki neono) elektronai išsidėstę dviem sluoksniais. Lentelės stulpeliai vadinami grupėmis. Vienos grupės elementai turi daug bendrų ypatybių. Pavyzdžiui, pirmosios (IA) grupės elementai (išskyrus vandenilį) labai aktyvūs šarminiai metalai. Jie reaguoja su vandeniu ir daugeliu kitų medžiagų, lengvai netenka vieno valentinio elektrono ir tampa jonais, turinčiais krūvį 1+. Antrosios (IIA) grupės elementai vadinami šarminių žemių metalais. Jie panašūs į pirmosios grupės metalus, tik reaguoja šiek tiek lėčiau. Reaguodami jie netenka dviejų elektronų ir tampa jonais, kurių krūvis 2+. Septynioliktosios (VIIA) grupės elementai – labai aktyvūs nemetalai, vadinamieji halogenai. Jie lengvai prisijungia papildomą elektroną ir virsta jonais, kurių krūvis 1–. Aštuonioliktosios (VIIIA) grupės elementai chemiškai neaktyvūs, nereaguoja nei su kitais elementais, nei tarpusavyje. Tai inertinės dujos. 1.1.2 paveiksle raudona spalva pažymėta laužtė rodo sąlyginę ribą tarp metalų ir nemetalų. Dalis prie šios ribos esančių elementų turi ir metalams, ir nemetalams būdingų savybių. Jie vadinami pusmetaliais (paveiksle pažymėti žaliai).
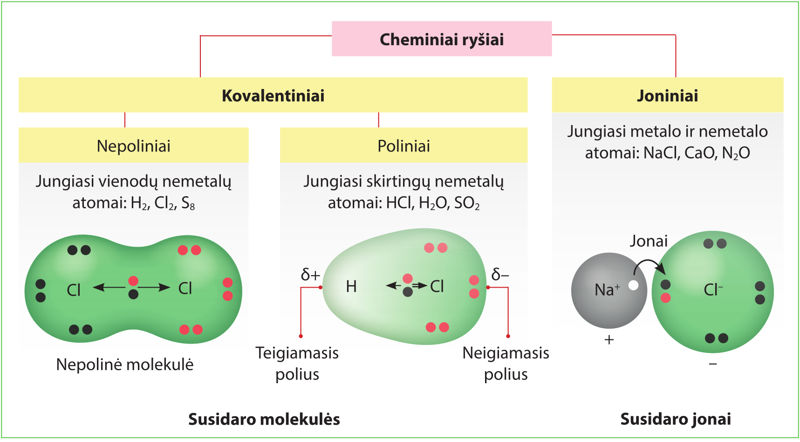
Cheminiai ryšiai
Atomams jungiantis susidaro cheminiai ryšiai. Pasikartoti cheminius ryšius padės 1.1.3 paveikslas.
Sunkusis vanduo
Įprasto maistui vartojamo vandens molekulė sudaryta iš dviejų vandenilio ir vieno deguonies atomo. Daugumos vandenilio atomų branduolys sudarytas tik iš protono. Toks vandenilis žymimas . Tačiau vandenilis, kaip ir kiti elementai, turi izotopų.
Vandenilis, kurio branduolyje yra vienas protonas ir vienas neutronas, žymimas
Vanduo, kuriame vietoj įprasto vandenilio yra deuteris, vadinamas sunkiuoju vandeniu (jo formulė D2O). Sunkusis vanduo yra didesnio tankio nei įprastas. Jis užšąla esant +3,8 °C, o užverda esant +101,4 °C temperatūrai. Cheminės reakcijos su sunkiuoju vandeniu vyksta šiek tiek lėčiau nei su įprastu. Tai galioja ir gyvybiškai svarbioms biocheminėms reakcijoms. Todėl sunkusis vanduo nuodingas.
Gamtiniame vandenyje yra šiek tiek sunkiojo vandens – iš 10 000 vandens molekulių tik 1 yra sunkiojo. Tokia maža koncentracija nėra pavojinga. Sunkusis vanduo naudojamas kai kurių tipų branduoliniuose reaktoriuose kaip neutronų lėtiklis. Tirdami cheminių ir biocheminių reakcijų dėsningumus mokslininkai naudoja sunkųjį vandenį arba kitus junginius, kuriuose įprastas vandenilis pakeistas deuteriu.
Klausimai ir užduotys
Atlikdami užduotis remkitės 1.1.1–1.1.3 paveikslais. Jei susiduriate su primirštomis sąvokomis, pasinaudokite interneto paieškos ir dirbtinio intelekto įrankiais.
- Nurodykite:
- iš kokių cheminių elementų sudaryta vandens molekulė;
- kiek elektronų turi deguonies atomas;
- iš kelių ir kokių dalelių sudarytas deguonies izotopo 17O branduolys;
- iš kelių ir kokių atomų sudaryta kofeino molekulė.
- Nurodykite, kaip struktūrinėse formulėse žymimi viengubieji, dvigubieji ir trigubieji kovalentiniai ryšiai.
- Pagal kalio padėtį periodinėje lentelėje nurodykite:
- kiek protonų yra kalio atomo branduolyje;
- keliais sluoksniais išsidėstę kalio atomo elektronai;
- kokio krūvio jonu tampa kalio atomas, reaguodamas su kitomis medžiagomis.
- Kokie cheminiai ryšiai susidaro jungiantis šiems atomams:
- natrio ir chloro;
- sieros ir chloro;
- dviem chloro atomams?
- Apskaičiuokite:
- vandens santykinę molekulinę masę;
- kofeino santykinę molekulinę masę;
- deguonies masės dalį vandenyje ir kofeine (atsakymą pateikite procentais).
