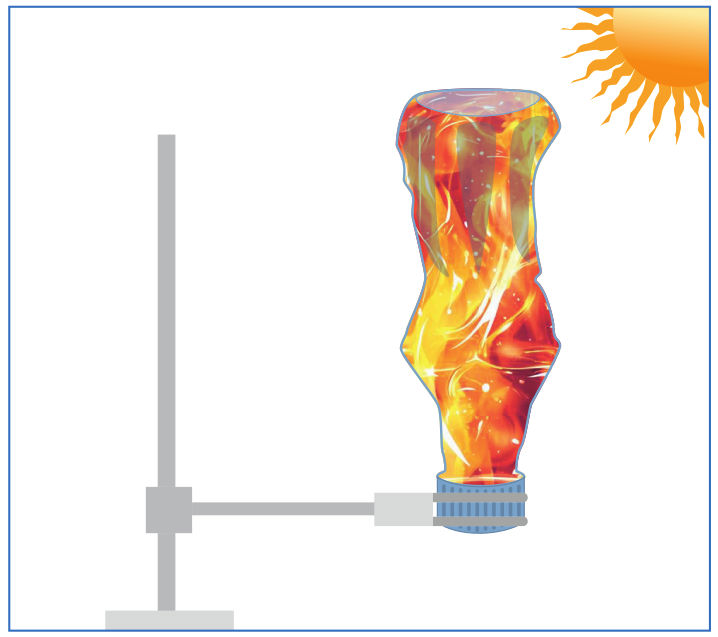
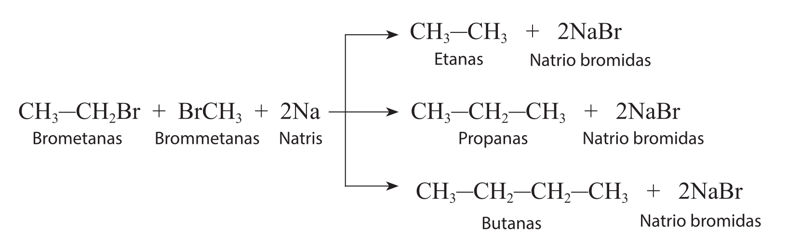
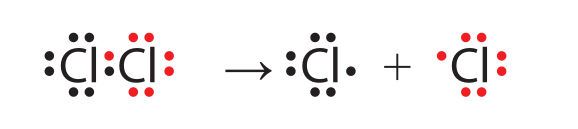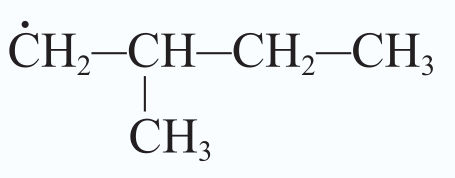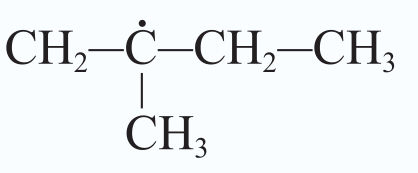Nors sočiųjų angliavandenilių junginiai neaktyvūs, apšviesti ryškios šviesos ar stipriai pakaitinti, jie reaguoja su halogenais, t. y. dalyvauja halogeninimo reakcijose: chlorinimo, brominimo ir pan. Pavyzdžiui, metano ir chloro mišinys, apšviestas Saulės šviesos arba fotoaparato blykstės, sprogsta (2.3.1 pav.). Taigi, kaip ir degimo reakcijoms, šioms reakcijoms sužadinti būtina aktyvacijos energija.
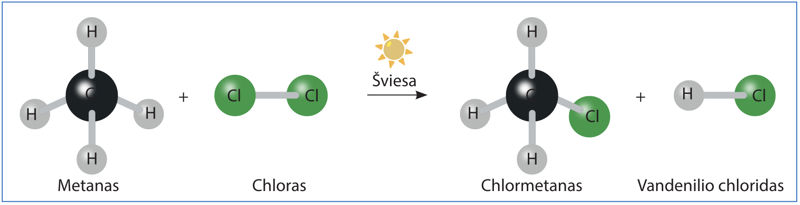
Metanui reaguojant su chloru chloras pakeičia vieną arba kelis metano molekulės vandenilio atomus – įvyksta pakaitų reakcija. Šios reakcijos produktai – angliavandenilio halogeninis darinys (chlormetanas) ir vandenilio halogenidas (vandenilio chloridas):
→ CH3Cl(d)+ HCl(d).ChlormetanasVandenilio chloridas
Vykstant pakaitų reãkcijai atomą ar grupę molekulėje pakeičia kitas atomas ar grupė. Šios reakcijos žymimos raide S (angl. substitution – pakeitimas).
Šią pakaitų reakciją galime pavaizduoti strypiniais molekulių modeliais (2.3.2 pav.).
Tuo ši reakcija nesibaigia ir vyksta toliau – esant chloro pertekliui, chloro atomais gali būti pakeisti du, trys ar net visi keturi vandenilio atomai. Pavyzdžiui, chloru pakeitus du vandenilio atomus, susidaro dichlormetanas ir vandenilio chloridas:
CH3Cl(d)+ Cl2ChlormetanasChloras → CH2Cl2(d)+ HCl(d).DichlormetanasVandenilio chloridas
Norėdami suprasti, kaip vyksta ši reakcija, panagrinėkime jos mechanizmą.
Chèminės reãkcijos mechanizmas – tai elementariųjų reakcijų seka, pateikiama atskiromis stadijomis.
Metano chlorinimo reakcija yra grandininė reakcija, kurią sudaro trys pagrindinės stadijos:
1. Inicijavimas. Kaip minėjome, metano sąveika su chloru prasideda reakcijos mišinį apšvietus arba stipriai pakaitinus. Dėl šio poveikio bendra elektronų pora, jungianti chloro molekulės atomus, suardoma – chloras suskyla į atskirus atomus:
Cl2→ŠviesaChloro molekulė Cl+ Cl.Chloro atomasChloro atomas
Ši reakcija Luiso formulėmis vaizduojama taip:
Chloro atomai turi po vieną nesuporuotą elektroną, todėl yra labai aktyvūs. Šių dalelių, vadinamų radikalais, gyvavimo laikas yra labai trumpas, siekia tik tūkstantąsias sekundės dalis.
Radikãlais (arba laisvaisiais radikãlais) vadinamos dalelės, kurių išoriniame elektronų sluoksnyje yra nesuporuotas elektronas.
2. Grandinės augimas. Aktyvus chloro atomas (chloro radikalas) atakuoja metano molekulę ir atplėšia jos vandenilio atomą – susidaro vandenilio chloridas ir metilo radikalas. Radikalus sutarta žymėti tašku prie elemento simbolio:
Cl·+ CH4Chloro radikalasMetanas→ HCl+ ·CH3.Vandenilio chloridasMetilo radikalas
Metilo radikalas, kuris turi vieną nesuporuotą elektroną, yra tokia pat aktyvi dalelė kaip ir chloro atomas. Metilo radikalas reaguoja su nauja chloro molekule – susidaro chlormetanas ir naujas chloro radikalas:
·CH3+ Cl2Metilo radikalasChloro atomas→ CH3Cl+ Cl·.ChlormetanasChloro radikalas
Taigi reakcija vyksta toliau, susidaro vis daugiau naujų aktyvių dalelių – radikalų. Viskas vyksta taip greitai, kad gali baigtis sprogimu.
3. Grandinės nutrūkimas. Reakcija nutrūksta nebelikus laisvųjų radikalų. Laisvieji radikalai sureaguoja tarpusavyje – susidaro arba chloro molekulė, arba reakcijos produktas chlormetanas, arba nauja medžiaga – etanas:
Cl· + Cl·→ Cl2.2 chloro radikalaiChloro molekulė
Cl·+ CH3Chloro radikalasMetilo radikalas → CH3Cl.Chlormetanas
·CH3 + CH32 metilo radikalai→ CH3CH3.Etanas
Sočiųjų angliavandenilių ir halogenų pakaitų reakcijos vyksta pagal radikãlinį pakaitų reãkcijos mechanizmą. Radikalinės pakaitų reakcijos žymimos raidėmis SR (angl. substitution – pakeitimas, radical – radikalinis).
Iš radikalinėse pakaitų reakcijose dalyvaujančių halogenų aktyviausias yra fluoras. Esant fluoro pertekliui, fluoras dažnai pakeičia iškart visus vandenilio atomus. Kiek mažiau aktyvūs chloras ir bromas. Su jodu tokios reakcijos vyksta tik ypatingais atvejais ir tik su kai kuriais junginiais, todėl laikoma, kad su jodu sotieji angliavandeniliai nereaguoja. Taigi halogenų aktyvumas kinta tokia seka:
F > Cl > Br > I.
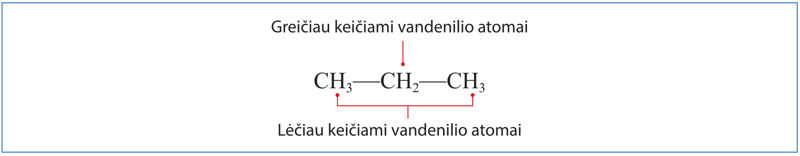
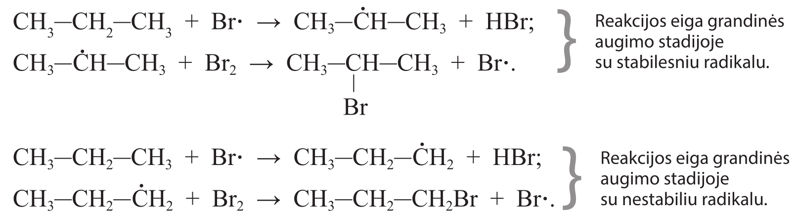
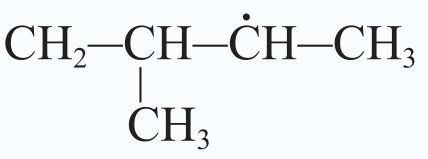
Numatant reakcijos eigą ir produktus atsižvelgiama į tai, kuriuos vandenilio atomus greičiausiai pakeis halogenai. Pavyzdžiui, jei pakaitų reakcijoje dalyvauja propano molekulė, pirmiausia bus keičiami vandenilio atomai, esantys anglies atomų grandinės viduryje (2.3.3 pav.).
Kodėl taip vyksta? Grandinės augimo stadijoje iš propano gali susidaryti skirtingi radikalai (2.3.4 pav.). Stabilesnis bus tas, kurio anglies atomas sujungtas su didesniu skaičiumi anglies atomų, t. y. šakotasis radikalas. Būtent su stabilesniais šakotaisiais radikalais reakcija vyks greičiau.
Šakotieji radikalai yra stabilesni.
Todėl propanui sąveikaujant, pavyzdžiui, su bromu, daroma prielaida, kad susidarys daugiau šakotojo brompropano, nes šakotasis radikalas yra stabilesnis:
Reakcijos mechanizmo žinojimas padeda suprasti, kodėl reakcija vyksta vienu ar kitu būdu, kodėl susidaro tam tikros sandaros produktai. Tai ypač svarbu atsirandant vis daugiau dirbtinio intelekto teikiamų galimybių. Galbūt ateityje bus galima sukurti naujų junginių gavimo būdų arba norimų savybių medžiagų.
Cheminių reakcijų mechanizmų tyrimų pradininkais laikomi du Didžiosios Britanijos mokslininkai – Kristoferis Kelkas Ingoldas (Christofer Kelk Ingold, 1893–1970) ir jo bendradarbis Deividas Edvardas Hjuzas (David Edward Hughes, 1906–1963). K. K. Ingoldas pirmasis pasaulyje išsamiai ištyrė chemines organinių junginių reakcijas ir įrodė, kad jos vyksta tam tikromis stadijomis. K. K. Ingoldo sukurta reakcijos mechanizmų žymėjimo sistema galioja iki šiol.
Seras K. K. Ingoldas (2.3.5 pav.) gimė Londone. Būdamas vos penkerių metų neteko tėvo. Gavęs krašto stipendiją, studijavo Sautamptono universitete, vėliau – Londono universitete. Tapęs šio universiteto profesoriumi sukūrė visiškai naują chemijos šaką – fizikinę organinę chemiją. Cheminės organinių junginių reakcijos imtos vertinti visiškai kitaip: dabar galima buvo numatyti iki tol nenuspėjamų reakcijų eigą ir rezultatus. Už šiuos pasiekimus prof. K. K. Ingoldui suteiktas lordo titulas. Tarp šio mokslininko stažuotojų buvo Vilniaus universiteto prof. Gervydas Dienys (g. 1934), kuris pirmasis Lietuvoje pradėjo tyrinėti reakcijų mechanizmus.